晚期非小细胞肺癌是肺癌中最常见的类型,指肿瘤已发生远处扩散或转移(如转移到对侧肺、胸膜、骨骼、脑部等),无法通过手术根治的阶段。此时,治疗目标主要是控制病情进展、延长患者生存期和改善生活质量。尽管分子靶向治疗和免疫检查点抑制剂在晚期非小细胞肺癌的治疗中取得进展,但患者的5年生存率仍仅为20%左右。因此,临床上亟需一种新型治疗策略来进一步提高患者的存活率和生存质量。
溶瘤病毒是一类能够选择性感染并摧毁肿瘤细胞,同时不损伤正常细胞的癌症疗法。该疗法潜力巨大,但溶瘤病毒作为单药治疗时仍面临诸多挑战。因此,将溶瘤病毒与其他治疗方式联合应用已成为攻克肿瘤免疫治疗难题的一个重要研究方向以及新型治疗策略。
在这一研究背景下,2025年8月日本香川大学医学部在期刊《Cancers》上发表了一篇题为《Antitumor Effects of Combination Therapy with Oncolytic Vaccinia Virus and Tepotinib on Lung Cancer Cells》的文章。

研究者系统评估了一种经过工程改造,在癌细胞中选择性复制的溶瘤痘苗病毒与已知能增强免疫反应的MET抑制剂tepotinib的联合效果:能够有效抑制肿瘤生长并增加免疫细胞浸润。
MDRVV和Tepotinib对肺癌细胞系的细胞毒性作用
研究者评估了MDRVV和tepotinib对肺癌细胞系A549、EBC-1和3LL的细胞毒性作用。细胞在培养3天后,用不同浓度的两种药物处理,计数细胞数量。尽管敏感性有差异,所有细胞在MDRVV或tepotinib处理下还是均发生细胞死亡。两种药物的组合产生了叠加细胞毒性效应(图1)。同时在所有三种细胞系中,通过Western blotting检测到了ERK1/2的磷酸化。
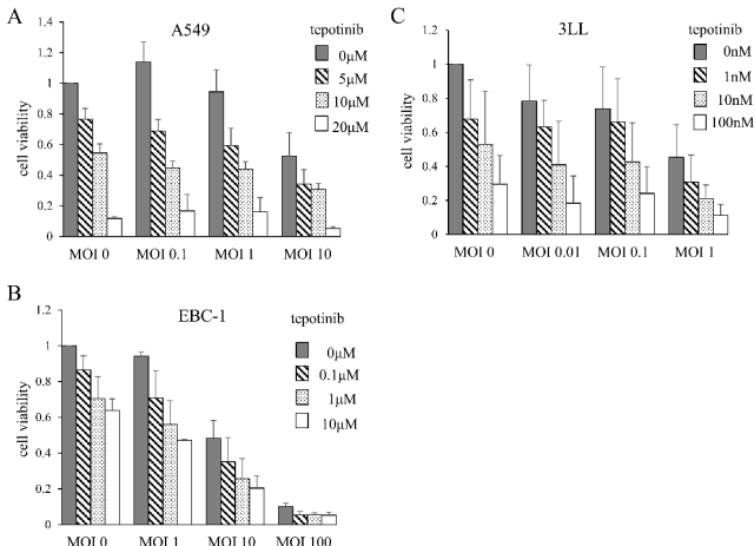
图1.MDRVV(MAPK依赖性重组痘苗病毒)与tepotinib(MET抑制剂)对肺癌细胞系的细胞毒性作用
培养上清液中的ATP浓度和HMGB-1表达
为了研究MDRVV是否诱导免疫原性细胞死亡,研究者测量了A549细胞培养上清液中的ATP浓度并评估了HMGB-1表达。MDRVV给药后,培养上清液中的ATP浓度在72至96小时达到峰值(图2A)。tepotinib或顺铂处理后未观察到ATP浓度增加(图2B)。收集MDRVV处理A549细胞3天后的上清液,使用Western blotting确认HMGB-1释放(图2C)。ATP和HMGB-1水平升高表明MDRVV诱导免疫原性细胞死亡。
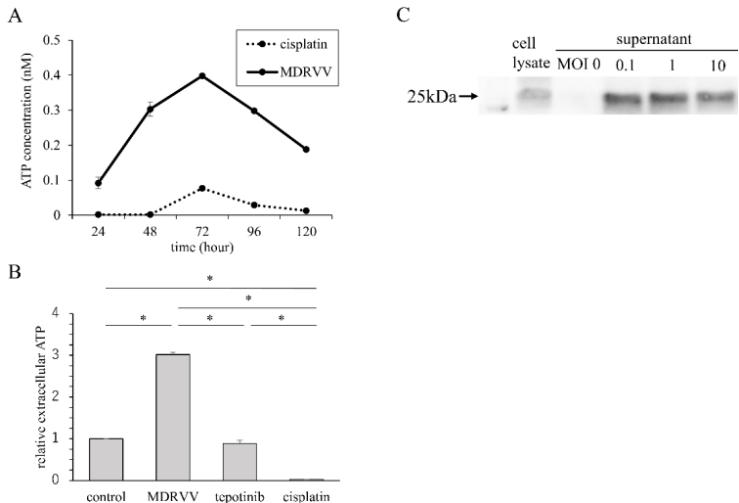
图2.A549细胞中免疫原性细胞死亡相关分子的增加
联合治疗抑制小鼠肿瘤进展
为了研究MDRVV是否发挥免疫介导的抗肿瘤效应,研究者使用具有完整免疫系统的C57BL/6小鼠,将200万个3LL细胞皮下接种到小鼠背部的两个部位。一周后观察到肿瘤形成。MDRVV仅在一个肿瘤中于第1天和第6天瘤内注射。Tepotinib每日腹腔注射。结果显示,与对照组相比,联合治疗组在MDRVV注射瘤与非注射瘤中均表现出显著的肿瘤生长抑制(图3A,B)。基于肿瘤生长导致安乐死终点绘制的Kaplan–Meier生存曲线表明,MDRVV和tepotinib单药治疗组与对照组相比均具有显著生存优势(均p<0.05,图3C);MDRVV和tepotinib组之间无显著差异(p=0.88);联合治疗组比MDRVV或tepotinib单药治疗组(均p<0.05)和对照组(p<0.001,图3C)生存期显著延长。
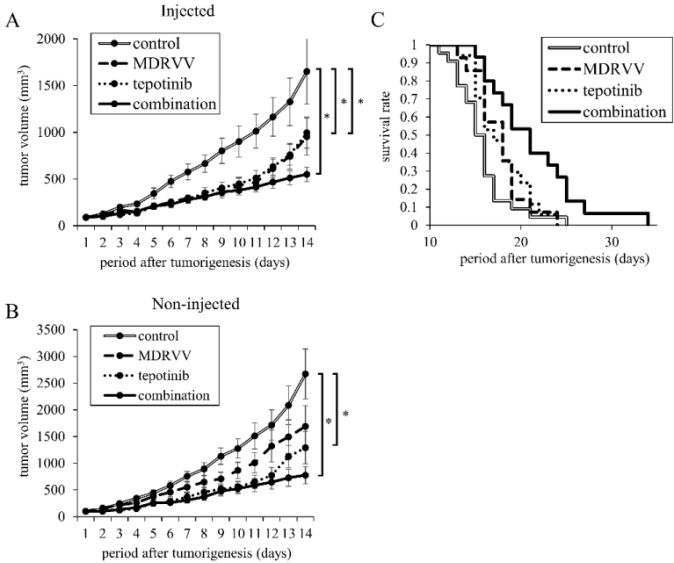
图3.MDRVV与tepotinib对小鼠肿瘤进展及生存情况的影响
治疗后肿瘤的病理学分析
小鼠肿瘤组织样本进行苏木精-伊红染色后观察发现,各组间未见明显的淋巴细胞浸润差异。为了研究MDRVV和tepotinib的免疫调节效应,研究者进行了CD4和CD8的免疫组织化学染色(图4)。在注射和未注射的肿瘤中,联合治疗组显示比单药组更高的CD4+和CD8+细胞浸润。具体而言,联合治疗组中CD8+细胞浸润显著更高,表明更强的免疫反应。
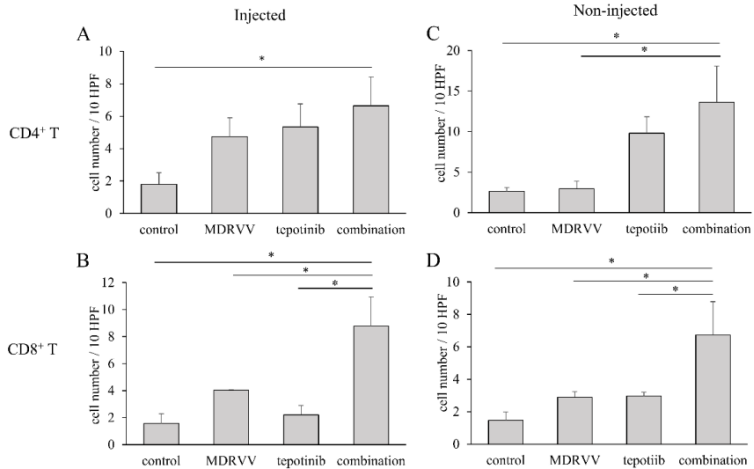
图4.肿瘤浸润淋巴细胞
结论:本研究证实MDRVV与tepotinib联合治疗通过双重机制发挥抗肿瘤作用:MDRVV诱导免疫原性细胞死亡(ATP/HMGB-1释放),tepotinib逆转免疫抑制微环境,协同促进CD4+/CD8+T细胞浸润,实现局部与远处肿瘤的同步抑制。该组合成功将"冷肿瘤"转化为"热肿瘤",通过激活癌症-免疫循环增强系统性抗肿瘤免疫。同时该联合治疗方案需进一步探索静脉给药剂量、PD-L1动态变化及详细免疫谱分析,为临床转化提供更充分依据。
这项研究揭示了联合疗法在肿瘤治疗中的巨大潜力,而要将这种潜力转化为可临床应用的现实,离不开专业的溶瘤病毒候选株构建与药效评价平台——而这正是迪福润丝生物的核心业务。
迪福润丝生物溶瘤病毒候选株构建服务
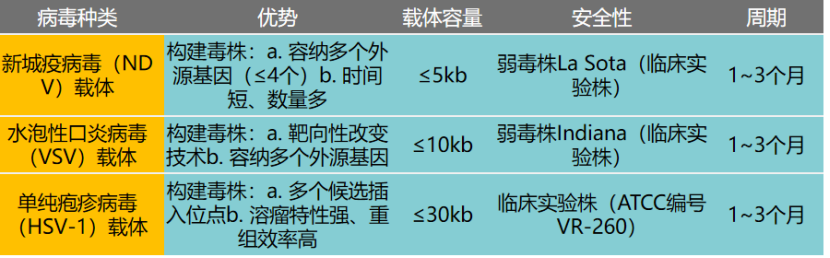
迪福润丝生物在溶瘤病毒药物的临床前研究方面具备系统化平台能力。公司通过对病毒株基因组进行改造,以提升溶瘤病毒的抗肿瘤活性。目前,公司可改造的溶瘤病毒载体涵盖新城疫病毒(NDV)、水疱性口炎病毒(VSV)、单纯疱疹病毒(HSV-1)等,已建立起多种类型的小鼠肿瘤模型,可为不同肿瘤提供系统性的溶瘤病毒有效性评价服务。
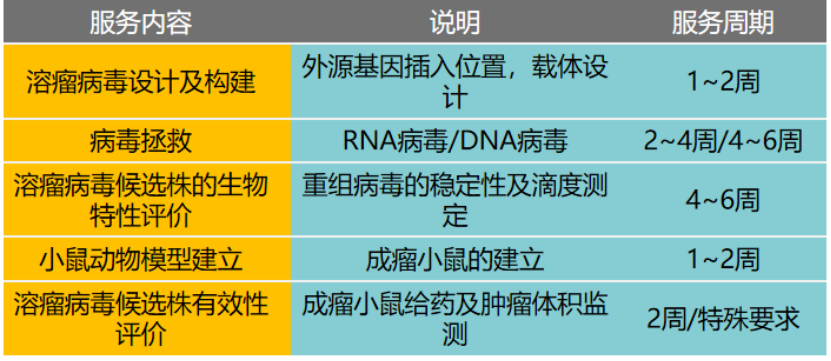
服务内容:
服务案例:
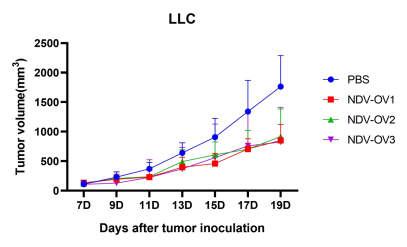
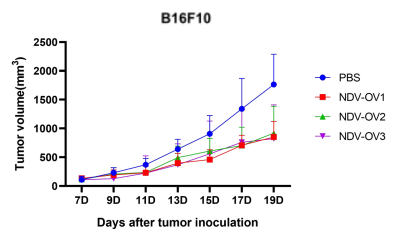
图5. 以NDV为载体的改造溶瘤病毒候选株(NDV-OV1,NDV-OV2,NDV-OV3)给药后,成瘤小鼠肿瘤体积变化。A:LLC成瘤小鼠;B:B16F10成瘤小鼠。
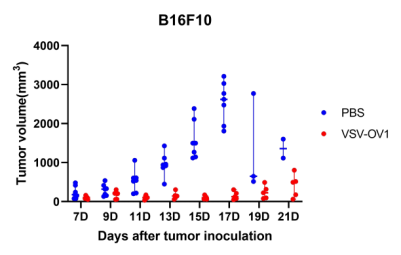
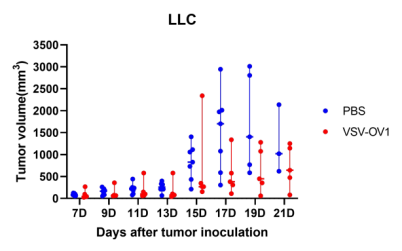
图6. 以VSV为载体的改造溶瘤病毒候选株(VSV-OV1)给药后,成瘤小鼠肿瘤体积变化。A:LLC成瘤小鼠;B:B16F10成瘤小鼠。
DIFF溶瘤病毒平台核心优势:
基于迪福润丝反向遗传操作技术平台(Viraltech Architect),可对绝大部分病毒进行基因工程改造。平台通过模块化的DCVL(Design-Construct-Verify-Learn)的方式,进行实验数据积累与更新迭代。
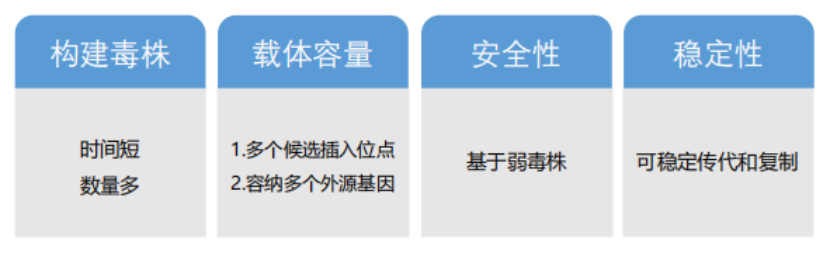
DIFF NDV载体优势:
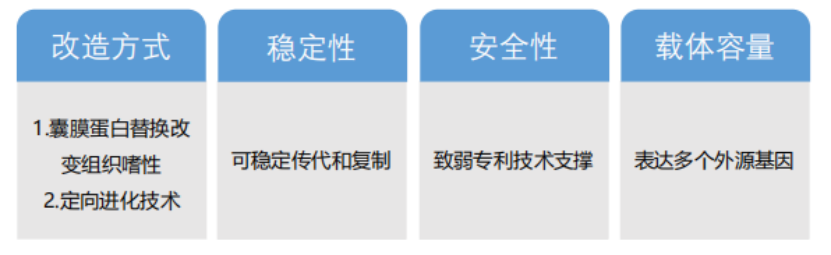
DIFF VSV载体优势:
迪福润丝生物依托全球领先的重组病毒载体技术平台,为溶瘤病毒疗法提供全流程CRO专业支持:从溶瘤病毒候选株构建(如新城疫病毒NDV、水疱性口炎病毒VSV载体等)、到动物模型药效评价以及活体成像分析。公司拥有专注于P2病毒类动物模型评价的企业实验室,加速创新疗法从实验室向临床转化,助力企业IND申报成功!
参考文献:
Inoue T, Kanaji N, Nakamura T, et al. Antitumor Effects of Combination Therapy with Oncolytic Vaccinia Virus and Tepotinib on Lung Cancer Cells. Cancers (Basel). 2025 Aug 18;17(16):2681.
